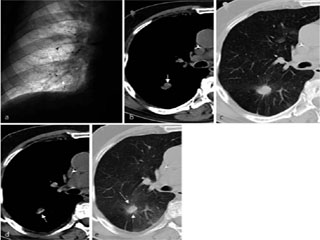
Abb. 1 Ansprechen auf die Therapie mittels TPCE im Falle eines 70-jährigen, männlichen Patienten mit Adenokarzinom der rechten Lunge (T1, N1, M0) nach zweimaliger Behandlung mittels TPCE. Nachweis einer moderaten Lipiodoleinlagerung. a Abschließendes Angiogramm der rechten tumorversorgenden Pulmonalarterie nach der ersten TPCE-Behandlung. Darstellung des Adenokarzinoms (Pfeile). Nachweis von Lipiodol in den Pulmonalgefäßen. b, c Natives CT in axialer Schnittführung, durchgeführt nach der ersten transpulmonalen Chemoembolisation. Nachweis einer moderaten Lipiodoleinlagerung, vor allem in der Tumorperipherie. d, e Follow-up-CT in axialer Schnittführung, einen Monat nach der ersten TPCE-Behandlung. Gut sichtbare Lipiodoleinlagerung in den Tumor (Pfeile). Es konnte eine Reduktion des Tumorvolumens von
1,0 ml auf 0,44 ml beobachtet werden.
Transpulmonale Chemoembolisation (TPCE)
Sehr geehrte Leser, liebe Patientin und Patienten,
auf den folgenden Seiten möchten wir Sie über die Möglichkeit einer Transpulmonalen Chemoembolisation (TPCE) informieren.
Minimal-invasive "lokalisierte Chemotherapie" Behandlung von Lungentumoren
Die Inzidenz für das Bronchialkarzinom nahm in den letzten Jahrzehnten rapide zu. Heute ist diese Tumorentität die häufigste maligne Erkrankung weltweit. In den USA steht das Bronchialkarzinom bei den malignen Erkrankungen an erster Stelle, sowohl bei den Männern als auch bei den Frauen. Im Jahre 2000 verzeichnete man dort ca. 164000 Neuerkrankungen,
157000 starben daran. Es ist eine Erkrankung des höheren Lebensalters; das Durchschnittsalter der Erkrankung liegt zwischen 65 und 75 Jahren. Am häufigsten handelt es sich bei dem Bronchialkarzinom um ein Plattenepithelkarzinom (34%), gefolgt von dem großzelligen Karzinom mit 28% und dem Adeno- und bronchioalverolären Karzinom mit 20%. Kleinzellige Karzinome werden in 17% der Fälle, gemischte in 1% der Fälle diagnostiziert. Die Prognose des Bronchialkarzinoms ist nach wie vor schlecht. Die beste Heilungschance bietet die Resektion im Stadium I und II. Insgesamt sind jedoch nur 25–30% dieser Tumoren resezierbar, 56% gelten bei Diagnosestellung bereits als inoperabel, 10% stellen sich intraoperativ als inoperabel heraus. Das Operationsrisiko wird mit einer Letalität bei Lobektomie von ca. 2,5 %, bei Pneumektomie von 7–15% angegeben. Die Frühmortalität liegt insgesamt bei 4%. Die mittlere Überlebenszeit aller Patienten beträgt 12 Monate, die 5-Jahres-Überlebensrate aller Bronchialkarzinome nur 10%, die mittlere 5-Jahres-Überlebensrate nach Resektion 23–50%, bei Inoperabilität 1%. Als Alternative zur operativen Versorgung oder als neoadjuvante Therapie wurden für die Stadien III bis IV unzählige Regime der palliativen Radiotherapie und der Chemotherapie entwickelt, mit kurzzeitig z. T. erfolgsversprechenden Ergebnissen. Die Langzeitergebnisse blieben jedoch ernüchternd. Die möglichen Nebenwirkungsprofile in der Dosierung der Chemotherapeutika stellen allerdings einen limitierenden Faktor dar. Aus diesem Grunde wurde bereits in den 50er-Jahren das Konzept der isolierten Lungenperfusion entwickelt. Dieses sieht eine Kanülierung der A. pulmonalis für den Zufluss zum Patienten sowie der beiden Lungenvenen für den Abfluss aus dem Patienten vor, wodurch ein geschlossener Perfusionskreislauf entsteht. Dies ermöglicht die Applikation eines hoch dosierten Zytostatikums direkt in die tumorbefallene Lunge, wobei eine systemische Belastung durch das Zytostatikum weitgehend vermieden werden kann. Nach der Perfusion wird
die normale Zirkulation wiederhergestellt. Dieses Konzept erwies sich im Tiermodell an einer Ratte der systemischen Chemotherapie als überlegen. Der Nachteil besteht allerdings darin, dass der Patient thorakotomiert werden muss, wodurch diese Behandlungsmethode nicht beliebig oft wiederholbar ist. Ein bereits in der Behandlung von Lebermetastasen etabliertes palliatives Verfahren ist die transarterielle Chemoembolisation. Diese verfolgt das Ziel einer Desarterialisierung mit daraus resultierender Nekrose des Tumorgewebes durch Einbringen eines
mit Embolisaten vermischten Chemotherapeutikums, das eine möglichst lange Verweildauer im Tumor ermöglicht. Da Lungentumoren neben dem bronchialen Netzwerk auch über die A. pulmonalis versorgt werden, bietet sich dieses Verfahren für die Behandlung dieser Tumoren an. Schneider verglichen im Jahre 2002 anhand eines CC531-Rattenmodells die Wirksamkeit von systemischer Chemotherapie, isolierter Lungenperfusion und Chemoembolisation der Lunge.
Dabei erwies sich die Chemoembolisation der intravenösen Chemotherapie als überlegen, die Effizienz von Chemoembolisation und isolierter Lungenperfusion waren vergleichbar. Der Vorteil der Chemoembolisation gegenüber der isolierten Lungenperfusion besteht allerdings darin, dass sie perkutan durchgeführt werden kann und somit eine Thorakotomie, wie bei der isolierten Lungenperfusion, nicht nötig ist. 2005 wurde erstmals eine Studie zur Evaluation der transpulmonalen Chemoembolisation bei Lungenmetastasen in vivo vorgestellt. Dabei konnte in 33% der Fälle eine Volumenreduktion der Metastasen erzielt werden. Ziel unserer Studie war es,
das Ansprechen primärer Lungentumoren auf die Behandlung mittels TPCE sowie auftretende Nebenwirkungen zu untersuchen.
Ablauf der Behandlung
Während der Durchführung der TPCE beschränkt man sich pro Therapiesitzung auf die Behandlung eines, maximal aber zweier Lungenlappensegmente. Die Behandlung wird in zwei bis
acht Sitzungen in 4-Wochen-Intervallen durchgeführt.
Nach Lokalanästhesie mit 1% Mepivacin wurde zunächst eine 7-F French-Schleuse in die rechte V. femoralis appliziert. Über diese wird ein 5-F Headhunter-Katheter (Terumo, Frankfurt/
Main) in die Pulmonalarterie platziert. Danach erfolgten eine angiographische Darstellung des arteriellen Gefäßsystems der zu embolisierenden Lungenhälfte und eine Sondierung der entsprechenden Segmentarterie mittels Headhunter-Katheter. Im Anschluss wird ein Ballonkatheter (Durchmesser 7mm; Länge 110 mm) in der ausgewählten Segmentarterie platziert. Abhängig von der Größe, der Lokalisation und dem Versorgungsgebiet der Arterien wird die Katheterspitze in die subsegmentalen Pulmonalarterien über einen Führungsdraht vorgeschoben. Um möglichst frühzeitig arteriovenöse Shunts auszuschließen, wird nach Blockung des Katheters eine kontrastmittelverstärkte Angiographie durchgeführt. Im Anschluss wird langsam unter Durchleuchtung 5mg/m2 Körperoberfläche (KOF) Mitomycin (Medac, Hamburg) als Chemotherapeutikum und bis zu 10 ml Lipiodol (Guerbert, Sulzbach) sowie 200 bis 450 mg Mikrosphären (Spherex; Pharmacia and Upjohn, Erlangen, Durchmesser: 20–70 µm) injiziert, bis der Blutfluss sistiert. Vor jeder Behandlung werden spezifische Laborparameter wie
Hämoglobin, Bilirubin- und Kreatininspiegel, Leuko- und Thrombozytenzahl, die Werte für die Alanin- und Aspartataminotransferase, der Cholinesterasespiegel sowie Gerinnungswerte
überprüft.
Zehn bis 48 Stunden nach der ersten Behandlung werden sowohl native als auch kontrastmittelverstärkte Computertomographien angefertigt. Dies wird dann im Abstand von einem Monat wiederholt. Nach Abschluss der sequentiellen Therapie folgen Intervallkontrollen im Abstand von 3 Monaten. Die Nachsorge erstreckt sich über einen Zeitraum von
mindestens sechs Monaten bis zu zwei Jahren. Alle Bilder werden im Verlauf mit den vorherigen verglichen, um Größenveränderungen der Tumoren registrieren zu können.
Mehr Informationen finden Sie auf unserem Flyer Thermische Ablation.pdf (5.3MB)
Fachbeiträge und wissenschaftliche Studien zur Myomembolisation